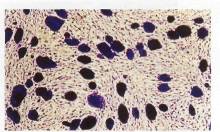
EK hücre kolonileri giemsa ile boyandığında farklılaşmamış koloniler koyu boyanırken, farklılaşan
koloniler daha açık tonlarda boyandılar.
Farklılaşmamış kolonilerin sınırları, çizgiyle çizilmiş
gibi belirgin ve net olduğu halde, farklılaşmaya
başlayan kolonilerin sınırları dağılan hücrelerden
dolayı belli belirsiz bir görünüme sahipti.
hedeflemekte. Besiyerine uygulanan büyüme faktörü kombinasyonlarının, miktarlarının ve zamanlamasının hesaplanması, hücrelerarası maddenin yerini alabilecek polimerik malzemeler ve üç boyutta doku gelişimini destekleyecek biyomateryal-ler ve matematiksel modellerin geliştirilmesi bu alanın sorumluluğunda. Amaç, tümüyle yapay bir ortamda hücrelere istenileni yaptırabilmek.
TÜBİTAK CMBAE Transgen ve Deney Hayvanları Laboratuavrında 2004 yılında bir kök hücre biyomühendisliği çalışması gerçekleştirildi. Kültür ortamındaki hayvansal ürünler olabildiğince uzaklaştırılarak, besleyici tabakaların yerini alabilecek, olabildiğince sentetik bir kültür sistemi geliştirilmeye çalışıldı. Besleyici tabakalar yerine Üç boyutlu fibröz bîr matris; serum yerine 'serum replacement' denilen sentetik bir çözelti kullanıldı.
Öncelikle hücreler besleyici tabakaların üzerinde altı farklı besiyerinde kültüre edildi. Popu-lasyon katlanma sayıları ve farklılaşmamış kolonilerin oranına göre en iyi besiyeri tanımlandı. Kullanılan çözeltilerin hücrelerin çoğalmaları üzerine bir etkisi olmadığı, ancak Serum Replacement (SR) uygulanan deney gruplarında kolonilerin daha az oranda farklılaşmış fenotip gösterdiği tespit edildi. Böylelikle deneyin ilk aşamasında hücrelere uygun bir kimyasal çevre hazırlanmış oldu.
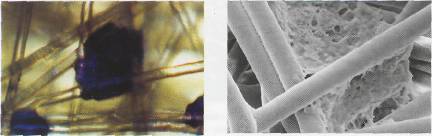
Deneyin ikinci aşamasında hücrelerin kültüre olduğu fiziksel çevre değiştirildi. Besleyici tabakaların üzerinden alınan EK hücreleri üç boyutlu fibröz bir matris olan dokunmamış poliester fabrik-lerinin (NWPF) üzerine aktarıldılar. NWPF diskle-
EMBRIYONIK
KÖK HÜCRELER
Hücrelerin daha sağlıklı ve farklılaşmadan çoğalmalarını sağlasa da hastalık tedavisinde kullanılacak insan EK hücrelerinin, hayvan hücrelerinin üzerinde kültüre edilmesi riskli. Fare hücrele-rindeki retroviruslar EK hücrelerin genomlarında mutasyonlara yol açabilirler. Bunun önüne geçmek için değişik tipte insan hücreleri besleyici tabaka olarak denenmiş durumda. Örneğin, 2003 yılında İsrail'de yapılan bir çalışmada, insan EK hücreleri yeni doğan bebeklerin sünnet edilmiş dokularından elde edilen hücrelerin üzerinde uzun dönem kültüre edilebilmiş.
Hücre kültüründe EK hücreleri kontrol etmenin yolu, tanımlanmış bir mikroçevreden geçiyor. Besiyeri bileşenleri, kültür kabı yüzeyleri, hücrelerin birbirleriyle komşulukları, bir hücrenin mikro-çevresini belirleyen koşulları oluşturuyor. Son yıllarda hızla gelişen bir dal olan kök hücre biyomü-hendisliği, kök hücrelerin istenilen yönde farklıla-şıp çoğalmaları için mikroçevreler yapılandırmayı
Embriyonik kök (EK) hücreler hasar görmüş dokuların yenilenmesi için eşsiz birer hücre kaynağıdır. Klinikte hasarlı dokuların yenilenmesi için aynı düzeyde farklılaşmış çok sayıda hücreye gereksinim duyulur. Teorik olarak EK hücreler sınırsızca bölünebildikleri için İstenilen sayıda hücreyi; vücuttaki hemen her çeşit hücreye dönüşebildikleri için de ihtiyaç duyulan tipte farklılaşmış hücre tiplerini oluşturabilirler. Ancak uygulamada durum farklıdır. Bu hücrelerin, kendileri gibi kök hücreler oluşturarak çoğalmalarını yani 'yenilen-me'lerini sağlamak zordur; çünkü EK hücre doğası gereği başka hücrelere farklılaşmak ister. Farklılaşmanın önüne geçebilmek için EK hücreler fare embriyolarından yalıtılan fibroblastlar üzerinde kültür ortamına sokulurlar, Fare embriyonik fib-roblastları, saldıkları birtakım faktörlerle EK hücreleri desteklerler. EK hücrelerin altında, kültür kaplarının yüzeyini tamamen kaplamış bu tek tabakalı hücre grubuna besleyici tabaka da denir.
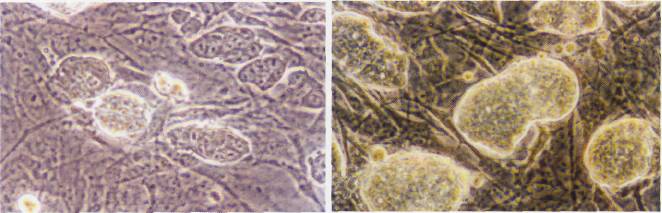
EK hücre kolonilerinin faz-kontrast mikroskoptaki görüntüleri. Farklılaşmamış hücrelerin birbirleriyle etkileşimi daha kuvvetlidir. Bu hücrelerin meydana getirdiği kolonilerin sınırları, çizgiyle çizilmişçesine belirgin olur ve faz kontrast filtrede parlak gözükürler. Yapılan çalışmada besleyici tabakaların üzerinde kültüre edilen koloniler besiyeri birleşenlerine göre farklı morfolojiler gösterdiler. SR içeren besiyerlerindeki koloniler daha belirgin sınırlara sahip, daha yuvarlak ve pürüzlü yüzeyler gösterirken, serumla kültüre edilen besiyerlerindeki koloniler daha basık ve pürüzsüz bir görünüme sahipti.
BİLİM ve TEKNİK 58 Ağustos 2005